ОПТИМИЗАЦИЯ ДИАГНОСТИЧЕСКОГО АЛГОРИТМА ИССЛЕДОВАНИЯ ОРГАНОВ ГЕПАТОПАНКРЕАТОДУОДЕНАЛЬНОЙ ЗОНЫ, КАК ОСНОВА ВЫБОРА ХИРУРГИЧЕСКОЙ ТАКТИКИ ПРИ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Достаточно
длительный исторический период клинического применения прямых и непрямых
методов визуализации ПЖ выявил следующую закономерность - в то время как для
диагностики распространенного рака ПЖ необходимо применение немногих
диагностических методик, для выявления маленькой опухоли ПЖ необходимо
использование всего возможного арсенала диагностических тестов.
Haddock G. и Carter D.C. (1990)
считали, что в арсенале клиницистов нет простых экономически эффективных,
неинвазивных и высокочувствительных методов исследования, которые могли бы
использоваться массово при раке ПЖ. И
хотя при этом многие из употребляемых исследований дают новую информацию об
опухоли, их результаты мало влияют на последующее лечение больного, что должно
приниматься во внимание и в плане минимизации стоимости, времени и страданий
больных (Ihse I., Isaksson G., 1984).
Более того, по
данным Japan Cancer Society (1993) и American CancerSociety (1995) даже
внедрение новых дорогих технологий существенно не влияют на выживаемость
больных раком ПЖ, только иногда они снижают количество ненужных диагностических
лапаротомий.
Как известно, выполнение инструментального исследования ПЖ направлено на решение следующих задач:
1. диагностика заболеваний ПЖ;
2. оценка состояния паренхимы и протоковой системы ПЖ, ЖП, а также смежных органов и тканей;
3. определение показаний к оперативному вмешательству и возможностей хирургической коррекции выявленных изменений.
Установление конкретного поражения ПЖ, является наиболее сложной задачей инструментального исследования. Для ее решения в свою очередь необходимо (Данилов М.В., Федоров В.Д., 1995):
1. установить факт поражения ПЖ;
2. определить конкретное заболевание ПЖ;
3. провести дифференциальную диагностику, в первую очередь между ХП и раком ПЖ;
4. определить распространенность патологического процесса;
5. выявить осложнения.
Комплексное применение современных
неинвазивных и инвазивных сонографических методик практически в 100% позволяет
поставить правильный диагноз рака ПЖ, не говоря уже о
применении эндоскопических и рентгенологических методов. Возникает вопрос об
очередности использования диагностических методов при раке ПЖ у конкретного
больного. Строго говоря, это стандартная логическая задача в довольно
специфической сфере деятельности. Она имеет свою главную цель и переменные по
значимости условия. Целью в этом случае является – постановка с максимально
достижимой вероятностью правильного диагноза, а условиями – минимальная
инвазивность, минимальные сроки, стоимость обследования и т.д.
Систематизированные правила использования инструментальной и лабораторной диагностики, при уточняющем исследовании патологии ПЖ, и в частности рака, таковы:
- от обязательных методов исследования к дополнительным;
- от более достоверных – к менее достоверным;
- от неинвазивных - к инвазивным;
- от определяющих конкретную лечебную тактику – к контрастирующим;
- от менее дорогостоящих – к более дорогостоящим;
В новых условиях функционирования здравоохранения (принципы страховой медицины), в стационарах на первом этапе разделяют обследования на обязательные, объем который должен выполняется всем больным, и дополнительные, выполняемые частично или полностью в зависимости от результатов первого этапа.
Обязательный объем инструментального обследования определен по следующим принципам:
- это минимальный объем исследований, позволяющий получить обоснованное представление о характере нарушений деятельности органов ГПДЗ;
- наличие именно этого минимального объема диагностических методик позволяет называть стационар специализированным и готовым к обследованию и хирургическому лечению больных с раком ПЖ.
Обязательные инструментальные
методы обследования включают: ТАУЗИ; ФГДС; РХПГ; рентгенологическое
исследование желудка и ДПК; рентгенографию позвоночника.
Обязательный объем инструментальных
исследований позволяет выявить основные морфологические и функциональные отклонения
в деятельности органов ГПДЗ, но прежде направлен на подтверждение имеющегося
объемного поражения ПЖ, его топическую диагностику, стадирование, диагностику
осложнений (механическая желтуха, панкреатическая гипертензия, портальная
гипертензия).
Использование обязательных
инструментальных исследований позволяет на первом этапе поставить
правильный диагноз у 81,7% больных. У остальных 18,3% результаты первого служат
основанием для использования дополнительных методов инструментального
обследования - КТ, ЧЧХГ, АГ, лапароскопия и пункционная биопсия ПЖ,
печени, лимфатических узлов.
Показания к дополнительным инструментальным исследованиям:
- противоречивые или сомнительные результаты обязательного обследования;
- высокий блок желчных протоков;
- диффузные поражения печени.
В тоже время, немногочисленный опыт
передовых хирургических клиник свидетельствует о том, что имеющиеся
сонографические методы исследования органов ГПДЗ позволяют поставить
правильный диагноз рака ПЖ у 100 % больных в предоперационном периоде и заранее
избрать рациональное хирургическое пособие.
В правилах использования
инструментальной диагностики требуется постановка методов, определяющих
конкретную лечебную тактику, на первое место. Поскольку именно они являются
основными поворотными пунктами на диагностической цепочке. Использование одного определяющего
метода, иногда по стоимости не превышает использование целого ряда не
определяющих методов. В тоже время экономится не только время, но и
оказывается меньшее психологическое воздействие на пациента многочисленными
процедурами.
С учетом сложности диагностики рака
ПЖ используют одновременно несколько методов инструментального исследования,
что повышает вероятность установления диагноза, однако нередко отмечается
чрезмерное и необоснованное использование инвазивных, а также малоинформативных
методов, что затягивает и удорожает обследование, повышает опасность его
побочных эффектов. Поэтому возникает необходимость выбора методов, наиболее
информативных и минимально достаточных для решения конкретных диагностических
задач - алгоритмирование инструментального обследования, предусматривающее
рациональное сочетание и последовательность проведения методов
инструментального исследования (Данилов М.В., Федоров В.Д., 1995).
Логическая зависимость звеньев
алгоритма заключается в том, что необходимость выполнения дальнейших
исследований определяется результатами предыдущих этапов обследования (Данилов
М.В., Федоров В.Д., 1995).
Поскольку информативность
неинвазивных методик (УЗИ, КТ) не уступает, а часто превосходит возможности
инвазивных методов, то Данилов М.В. и Федоров В.Д. (1995) считают, что основной
принцип построения диагностических алгоритмов заключается в преимущественном
использовании неинвазивных методов.
Изолированное первичное ТАУЗИ
органов панкреатодуоденальной зоны в настоящее время по праву стал
методом выбора неинвазивной инструментальной диагностики рака ПЖ и его
осложнений. Этот метод дает возможность в короткий срок получить данные о
топографоанатомических взаимоотношениях опухоли ПЖ и окружающих ее органов и
тканей. Использование КТ как метода отбора является, по мнению Данилова М.В. и
Федорова В.Д. (1995), нецелесообразным в связи с высокой стоимостью процедуры,
длительностью ее проведения, значительной лучевой нагрузкой на больного, а
также в связи с необходимостью его специальной подготовки. В сомнительных
случаях, когда при УЗИ высказывается предположение о возможности опухоли ПЖ,
основным звеном диагностического алгоритма является, по мнению авторов КТ.
Выявление инструментальными методами
рака головки ПЖ III стадии служит показанием для
выполнения рентгенологического исследования с целью установления
нарушений проходимости ДПК, требующих оперативной коррекции. При выявлении
обширных опухолей IV стадии с метастазами в печень,
парааортальные ЛУ и др. диагноз верифицируется прицельной пункцией пораженных
узлов под контролем КТ или УЗИ с цитологическим исследованием пунктата, что во
многих случаях позволяет отказаться от операции в пользу симптоматического лечения.
При подозрении на рак ПЖ, осложненный МЖ, вторым этапом обследования, после
ТАУЗИ, является ФГДС, которую нужно рассматривать как обязательный способ
дифференциальной диагностики между опухолями периампулярной зоны. Выявление
обширных опухолей БДС и ДПК, суживающих просвет последней, требует
дополнительного рентгенологического исследования (Данилов М.В., Федоров В.Д.,
1995).
Таким образом, отличием
диагностического алгоритма при раке ПЖ, сопровождающимся МЖ, является
обязательное включение ФГДС, широкое использование методов прямой
холангиографии, часто завершающихся «бескровной» декомпрессией желчных путей и
в большинстве случаев оперативным вмешательством (Данилов М.В., Федоров В.Д.,
1995). Применение алгоритмов инструментального обследования у больных раком ПЖ
позволяет прежде всего повысить эффективность выявления и дифференциальной
диагностики, а с другой стороны, избежать необоснованного применения ряда
диагностических методов, снизить стоимость и уменьшить инвазивность
инструментального обследования, а следовательно уменьшить число осложнений,
возникающих в ходе диагностического процесса.
Существующие тенденции приводят к
увеличению числа ненужных методов обследования, тем самым повышая себестоимость
медицинских услуг без непосредственного улучшения отдаленных результатов
лечения рака ПЖ. Разумно было бы избегать применения многочисленных
диагностических средств, выбирая наиболее эффективные для каждого больного, а
подобные действия, в свою очередь, требуют знаний чувствительности,
специфичности и диагностической точности применяемых методов. Поэтому целью
предоперационной диагностики и стадирования рака ПЖ должна быть уверенность,
что каждый больной получит наиболее необходимое ему лечение с минимальным
риском и приемлемой клинической и экономической эффективностью.
Рациональное сочетание методов
диагностики и стадирования всегда приводит к использованию неинвазивных методик
как первой линии обследования. Обычно неинвазивные или минимально инвазивные
методы дешевле, чем инвазивные. Но такие основные условия как, минимальная
инвазивность и стоимость, иногда противоречат друг другу.
На основе подобных заключений и
согласно этической и экономической философии работы врача в данном клиническом
направлении предлагаются схемы (алгоритмы) диагностики, стадирования и
хирургического лечения рака ПЖ.
Международный противораковый
союз (2001) для развитых стран предлагает следующую схему диагностики и
стадирования рака ПЖ (Рис. 1). При этом оговаривается, что при определенных
обстоятельствах последовательность исследований может быть изменена и даже
остановлена на любой стадии, поскольку диагностический алгоритм для любого
больного полностью зависит от таких факторов как, используемое оборудование и
экспертиза; одинаковое исследование может иметь различные уровни точности, в
зависимости от инструментов и как, и кем, они используются. Так же приводится
спорная мысль, что полезно и экономически эффективно доводить до конца
хирургические попытки, которые в тоже время являются и диагностическими,
стандартными и даже лечебными, чем выполнять огромное количество дорогих
исследований, чей успех зависит от ряда факторов и не в последнюю очередь от
оператора и его аппаратуры. То есть результативность методов диагностики все
еще зависит от исследователя и только в будущем будут объективными.
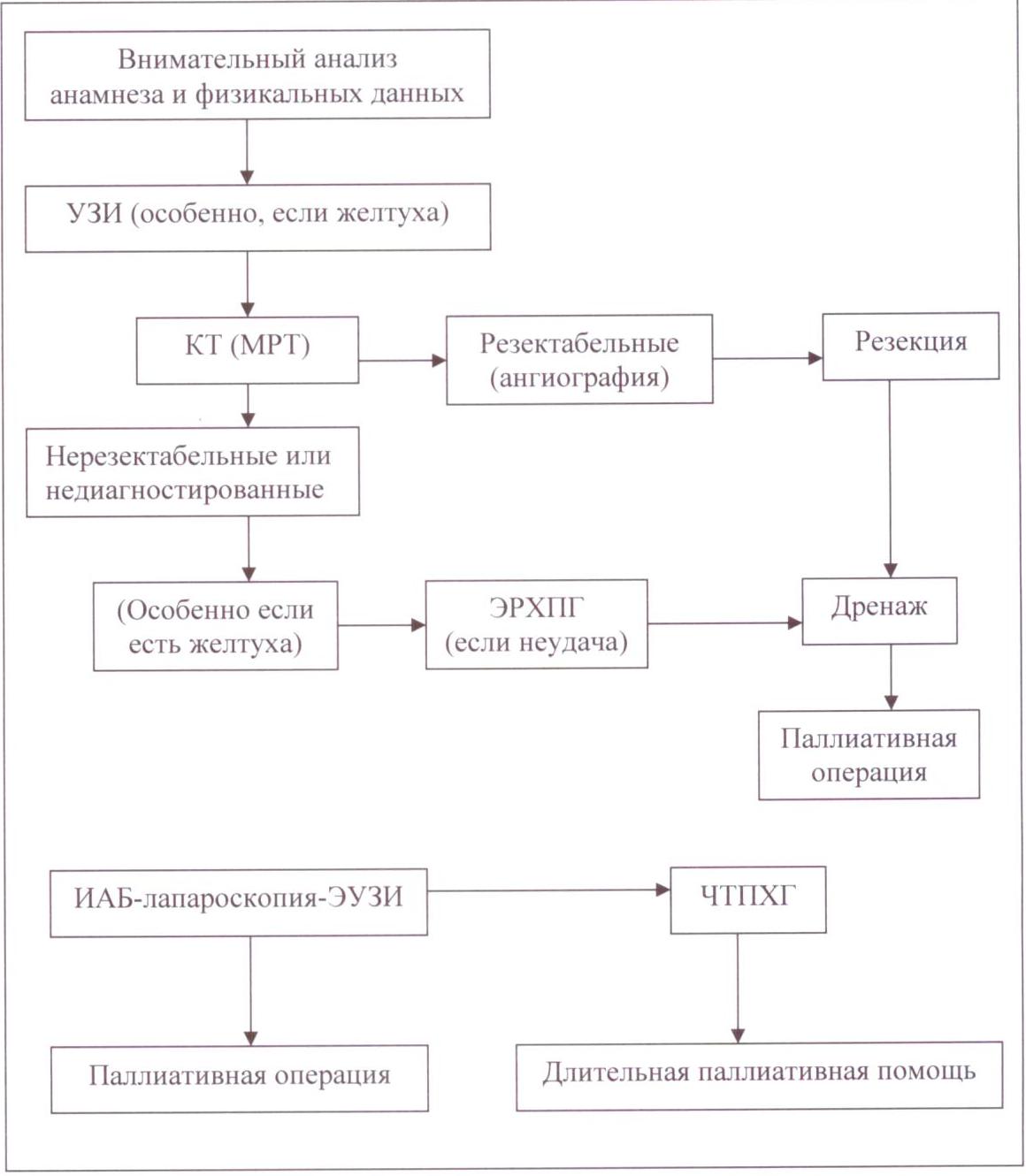
Рисунок 1. Схема диагностики и стадирования рака ПЖ в развитых странах (Блинов Н.Н., Константинова М.М., 2001).
Следует признать, что данный алгоритм только в общих чертах описывает возможные действия хирурга при определенных ситуациях, без конкретных указаний на способ оперативного вмешательства, в первую очередь радикального.
Однако, приведенная схема отражает тот качественный скачок и принципиальное изменение способа построения лечебно-диагностического алгоритма, который произошел за последние 20 лет. Поскольку широко стали применяться принципиально новые методы ЭУЗИ, КТ, МРТ, а ТАУЗИ стало рутинным. Тогда как еще совсем недавно подобные алгоритмы строились на основании лабораторной дифференциальной диагностики желтух, дуоденоскопии, лапароскопии, ангиографии, сканировании и различных типов холангиографии. Биопсия была возможна только интраоперационная, а о широком применении диагностического транспариетального ультразвука, чрескожной тонкоиголькой или трепан-биопсии под ультразвуковым контролем не было и речи (Блохин Н.Н. и соавт., 1982).
В настоящее время, с внедрением в
практику доплеровского ультразвукового исследования, появилась возможность
отказаться от применения крайне сложного, дорогого, инвазивного, опасного
метода как ангиография; время затраченное на дифференциальную диагностику
желтух, равняется времени выполнения стандартного ТАУЗИ (Малярчук В.И., Климов
А.Е., Пауткин Ю.Ф., 2006).
Именно освоение современных способов
прямой чрескожной неинвазивной визуализации ПЖ и магистральных сосудов, позволило
революционно изменить представление о возможности дооперационного изучения
опухоли ПЖ и построения четкого плана операции.
Вероятность правильного диагноза
рака ПЖ, установленного методами прямой визуализации (сонография, КТ, МРТ),
настолько высока, что практически исключается необходимость морфологической
верификации объемного образования ПЖ с помощью чрескожной биопсии, особенно в
тех случаях, когда планируется радикальное оперативное лечение, так исключается
и фактор имплантационного метастазирования (Warshaw A.l.,Fernandes-DelCastillio C., 1992; Lillemoe К.D. et al., 1996; Pelsang R.E., JohhlinF.C., 1997).
Основываясь на постулате
комплексного применения нескольких исследований J.L.Cameron (2001) приводят свою схему
обследования и выбора способа оперативного лечения, ставя на первый этап
определение уровня опухолевого маркера СА 19-9 и спиральную КТ, а затем
выполняют ЭУЗИ. И даже при этом в ряде случаев истинное распространение опухоли
удается определить только во время лапаротомии.
Основываясь на результатах операций
по поводу «псевдотуморозного хронического панкреатита», при последующей
гистологии у которых от 12% (Г.-Б.Зегер, 2000) до 50% (Путов Н.В.,
Артемьев Н.Н., Коханенко Н.Ю., 2005)выявляется рак ПЖ, авторы предлагают
выполнять резекцию ПЖ при подозрении на опухоль, поскольку никакие современные
методы до- и интраоперационной диагностики, включая биопсию ПЖ, не дают
абсолютно достоверных результатов. При этом авторы основными дифференциально-диагностическими
критериями рака ПЖ и ХП признают клинические данные: возраст, пол, наличие
желтухи, потеря массы тела (Путов Н.В., Артемьев Н.Н., Коханенко Н.Ю., 2005),
оставляя возможности инструментальной диагностики за скобками. Даже интраоперационная
инструментальная диагностика считается авторами бессильной для определения
инвазии опухоли в магистральные сосуды, отдавая примат пробной мобилизации
опухоли.
При этом постоянно дискутируется
вопрос о критериях резектабельности опухоли ПЖ в связи с инвазией магистральных
сосудов, окружающих клетчаточных полей, нервных сплетений, полых органов,
метастазами в лимфоузлы и печень. Хотя уже последние 15 лет все
вышеперечисленные изменения не останавливают хирургов в стремлении удалить
опухоль и отдаленные результаты, при достигнутой крайне низкой
послеоперационной летальности (4-8%), становятся сравнимыми с результатами
традиционно признанных радикальных операций, отмечаются многие случаи
пятилетней выживаемости до 26%-50% (Ishikawa O. Et al., 1988; 1996; Braasch J.W., Tompkins R.K., 1994; Kayahara M. et al., 1992;
1995).
На современном этапе многие хирурги
признают размывание граней между так называемыми циторедуктивными и
радикальными операциями при раке ПЖ, считая первые обоснованными по
вышеуказанным мотивам (Кубышкин В.А., Вишневский В.А., 2003).
Таким образом, на смену принципу
определения неоперабельности опухоли ПЖ (инвазия магистральных сосудов,
метастазы в печень, лимфатические узлы и т.д.) и отказу от оперативного
лечения, приходит новый взгляд на возможности самостоятельного хирургического и
комбинированного методов лечения, который оценивает признаки местного и
отдаленного распространения рака ПЖ только с позиции своевременного
дооперационного их выявления, четкой количественной и качественной оценки, для
построения индивидуальной хирургической тактики и выбора
оптимального вмешательства по удалению опухоли. Резекция и пластика
магистральных сосудов, временное обходное шунтирование кровотока, резекция
долей и сегментов печени, расширенная лимфаденэктомия и нейродиссекция требуют
определенной материальной и технической подготовки операционной бригады,
формирования четкого плана операции (Оноприев В.И. и соавт., 2002, 2003, 2005; Кубышкин
В.А., Вишневский В.А., 2003; Малышева Ф.А., 2005).
С указанных позиций, очевидно, что
основные критерии распространенности опухоли ПЖ определяются только с помощью
методов прямой визуализации ПЖ и органов периампулярной зоны (УЗИ, КТ, МРТ,
лапароскопия, ФГДС). В каждой хирургической клинике при раке ПЖ выстраивают
диапевтический алгоритм, отражающий возможности данного учреждения, его
объективных и субъективных предпочтений в использовании указанных методов.
Хирурги, ориентируясь на показатели диагностической точности, инвазивности,
временных и материальных затрат при использовании тех или иных методов
интраскопии, выстраивают стандартный алгоритм их применения, поскольку только
при опоре на полученные в оптимальные сроки данные возможно
выработать хирургическую тактику и выполнить хирургическое вмешательство, не выходя
за рамки стандартных сроков госпитализации, реабилитации и материальных затрат
на лечение.
Примером оригинального тактического
алгоритма может служить схема, используемая в США, характеризуемая Кубышкиным
В.А. и Вишневским В.А. (2003), как «наиболее правильная», приведенная на рис.
2. Данный алгоритм отражает те предпочтения хирургов определенным методам
исследования, к которым у них имеется высокая степень доверия, а выполняемые
оперативные вмешательства отражают взгляд клиники на резектабельность рака ПЖ.
К некоторым недостатком указанного
алгоритма можно отнести отсутствие регламентации по выполнению расширенных и
комбинированных вмешательств, действиям при билиарной и портальной обструкции.
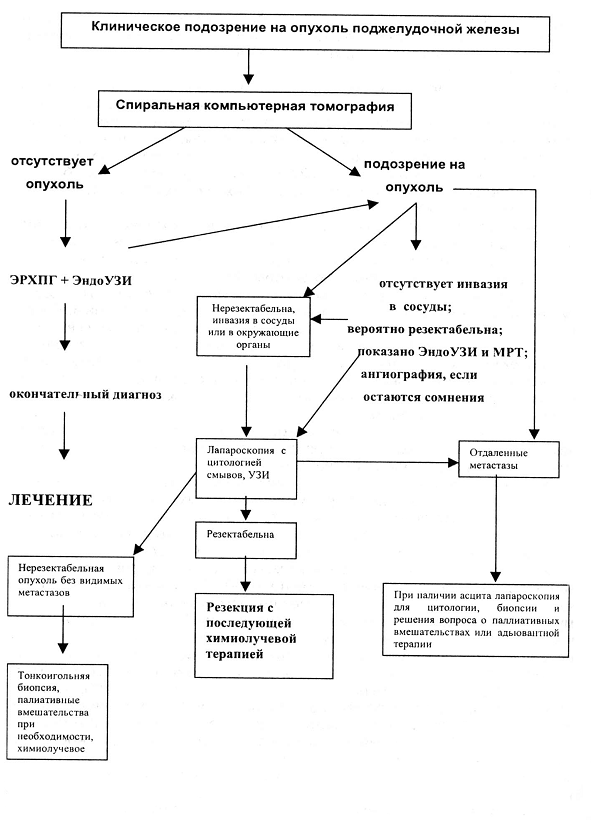
Рисунок 2. Алгоритм предоперационного обследования больных с подозрением на рак поджелудочной железы.
Следует отметить, что приведенный пример построения логических взаимосвязей между выявленными изменениями и выполненными последующими действиями в виде дополнительных инструментальных исследований или хирургических вмешательств при раке ПЖ, достаточно уникален. Дело в том, что традиция диагностики опухоли ПЖ, дифференциальной диагностики ее с опухолями периампулярной зоны и хирургического лечения в литературе практически неразделимы. Поскольку принято считать, что клинические проявления и принципы хирургического лечения рака ПЖ и рака органов периампулярной зоны в зачастую схожи. Поэтому и приводимые в литературе оригинальные диагностические и тактические алгоритмы включают в себя все традиционные периампулярные локализации рака (Малярчук В.И., Климов А.Е., Пауткин Ю.Ф., 2006).
Существует до сих пор проблема
терминологии по отнесению рака ПЖ к периампулярной локализации.
Несогласованность в терминологии и различие прогностических возможностей
указанных выше локализаций рака не позволяет однозначно толковать применяемые
термины, не позволяет проводить достоверный сравнительный анализ результатов
исследования (Reber H.A.et al., 1995).
В настоящее время с целью
обозначения злокачественных опухолей головки ПЖ, БДС, ДПК и терминального
отдела общего желчного протока большинством авторов используется термин -
"панкреатодуоденальный рак". Н.Н.Блохин (1982) объединил данные органы
формулировкой - "билиопанкреатодуоденальная зона". Первое применение
термина - "периампулярный рак", имеется у А.В.Смирнова (1959, 1960) и
R.B.Cattell et al. (1959). Встречаются и другие формулировки, но они
используются относительно редко. В.А.Кубышкин (1993, 1995, 1998) отмечает, что
новообразования обозначенной локализации, большинством зарубежных хирургов
объединены названием - "периампулярные опухоли" и
"периампулярный рак", что наиболее полно отвечает требованию
лаконично и емко отразить локализацию опухолевого процесса, поскольку органы
периампулярной зоны расположены в сравнительно небольшой области, имеют тесную
анатомическую связь, а при их злокачественном поражении проявляется сходная
клиническая картина и выработана единая хирургическая тактика.
Однако накапливаемый опыт
хирургов-панкреатологов все больше склоняет мнение в сторону выделения рака ПЖ
из традиционного периампулярного квартета. Поскольку, клиника рака ПЖ, особенно
ее дистальных отделов или тотального поражения, особенности местного и
отделенного распространения, прогноз, возможности применяемых методов
радикального хирургического лечения, комбинированного лечения и отдаленные
результаты выделяют данную локализацию как исключительную, то требуется
проводить исследования, опираясь только на панкреатическую локализацию рака,
вычленив ее из периампулярной области, как самостоятельную. Данная тенденция
закреплена во многих монографиях Блохин Н.Н., Итин А.Б.,
Клименков А.А., 1982; Braasch J.W., Tompkins R.K., 1994; Кузин Н.М., Егоров А.В.,
2001. Cameron J.L., 2001;
Кубышкин В.А., Вишневский В.А., 2003; Путов Н.В., Артемьев Н.Н., Коханенко
Н.Ю., 2005;Gress T.M. et al., 2006.
Современные методы прямой
визуализации позволяют уже на первом этапе диагностики дифференцировать
панкреатическую и иную, в том числе периампулярную, локализацию рака, как с
помощью сонографии, так и рентгеновской компьютерной томографии, без применения
инвазивных и внутриполостных методов диагностики (Иванов В.А., 2004). Данный
феномен, характеризующий современный этап развития хирургии рака ПЖ, позволяет
строить лечебную тактику на иных позициях, нежели двадцать лет назад.
Краснодар - Москва - 2008 г.
· Новиков С.В.
· кмн, врач-хирург высшей категории, врач УЗД,
· специалист по минимально инвазивным хирургическим вмешательствам под
контролем ультразвука