ДИАГНОСТИЧЕСКИЕ ВОЗМОЖНОСТИ ИНСТРУМЕНТАЛЬНЫХ МЕТОДОВ ИССЛЕДОВАНИЯ ПРИ НОВООБРАЗОВАНИЯХ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
В связи с труднодоступностью
расположенной забрюшинно ПЖ диагностика ее новообразований всегда являлась
довольно сложной задачей. Учитывая значимость результатов диагностики для
формулирования лечебной тактики, нетрудно оценить необходимость своевременного
эффективного обследования пациента.
При выборе метода визуализации врач должен ответить на следующие вопросы (Мартынова Н.В. и соавт., 2005):
1. Необходимо ли вообще применение метода визуализации для определения тактики лечения?
2. Какой метод должен использоваться как первичный?
3. Нужны ли дополнительные методы визуализации и какие из них наиболее информативны?
Основой дооперационной диагностики рака
ПЖ являются инструментальные методы исследования: ТАУЗИ, КТ, ЭРПХГ, АГ,
чрескожная чреспеченочная холангиография, пункционная биопсия и лапароскопия
(Патютко Ю.И., Котельников А.Г., 1997) ).
ТАУЗИ
для диагностики очаговых и диффузных поражений ПЖ используется нами более 12
лет. Этот метод диагностики был применен всем пациентам, находящимся на
обследовании и лечении в клинике.
ТАУЗИ,
являясь первым скрининговым способом исследования ПЖ, нередко по характерной
визуальной картине дает возможность поставить окончательный диагноз (Постолов
П.М. и соавт., 1991; Bryc S., Krasniak J., 1992., Pettersson H., 1995).
В
публикациях Барыкова В.Н. (2000), показано использование ТАУЗИ как
скрининг-метода, позволяющего поставить диагноз до операции. Схожего мнения
придерживаются Харнас С.С., Кулезнева Ю.В., Лачман Д. (2003), показывая, что
ТАУЗИ, являясь первым скрининговым способом исследования ПЖ, нередко по
характерной УЗ-картине дает возможность поставить окончательный диагноз при
различных формах хронического панкреатита и эпителиальных опухолях.
Одним
из основных стратегических критериев в выборе метода лечения злокачественных
новообразований ПЖ является локализация и размер неопластических очагов.
Диагностические возможности различных методов исследования и, в частности,
ТАУЗИ, прямо коррелируют с вышеназванными критериями.
Так, при локализации опухоли диаметром
более 2,0 см в головке ПЖ, диагностическая точность ТАУЗИ достигла 99%, в то
время как эхолокация очагов менее 1,0 см соответствовала истине у 70%.
Котляров П.М. (1999) приводит данные
чувствительности ТАУЗИ при раке головки ПЖ - 80% и специфичности - 60%, не
проводя, однако, зависимости от размеров диагностированного образования.
В
исследованиях Кармазановского
Г.Г. и соавт. (2001) показана
чувствительность ТАУЗИ в диагностике рака головки ПЖ 74%. Схожие показатели
диагностических возможностей ТАУЗИ приводит Кубышкин
В.А. и соавт. (2000) - чувствительность в диагностике рака головки ПЖ – 73,8%,
специфичность – 75%, общая точность – 74,3%.
Тактически
важным и особо проблематичным является диагностика очаговых образований, расположенных
в крючковидном отростке головки ПЖ. ТАУЗИ по полученным данным выявляет
новообразования этой локализации с точностью 70% при размерах до 1,0 см и 85% -
при размере более 2,0 см.
По
мнению Банифатова П.В. (2002), важное диагностическое значение имеют не сами
размеры, а форма ПЖ, выявляемая при ТАУЗИ. По данным автора в большинстве
случаев размеры постепенно уменьшаются от головки к хвосту. Реже встречается
форма с «толстыми» головкой и хвостом и относительно тонким телом.
Рак
хвоста железы характеризуется длительно бессимптомным течением (Котляров П.М.,
1999).
По
полученным нами данным размер новообразований дистальной части ПЖ у большинства
больных (85 пациентов) превышал 2,0 см. В этих случаях диагностическая точность
ТАУЗИ составила 89%, в то время как возможности диагностики очагов менее 1,0 см
не превышали 65%.
Большая
опухоль хвоста железы может тесно прилежать к селезенке, верхнему полюсу левой
почки, надпочечнику. По мнению Котлярова П.М. ТАУЗИ и КТ не могут уточнить
органопринадлежность опухолей этой локализации (Котляров П.М., 1999).
В
исследованиях Кармазановского
Г.Г. и соавт. (2001) показана
чувствительность ТАУЗИ в диагностике рака хвоста ПЖ 90%.
Зависимость
диагностических возможностей ТАУЗИ от размеров новообразования изучали Панцырев
Ю.М. и соавт. Показано, что точность ТАУЗИ при раке ПЖ диаметром менее 3 см –
54-61% (Панцырев Ю.М. и соавт., 1999).
Прилежащие
к передней поверхности головки и тела ПЖ привратник и антральный отдел желудка
при наличии в нем воздуха, дают акустическую тень, что затрудняет
сонографическую визуализацию ПЖ. А при заполненном жидкостью желудке источником
ошибок может оказаться его задняя стенка, дающая сигнал, похожий на сигнал
главного панкреатического протока.
Несмотря
на то, что гипоэхогенная структура ткани солидной опухоли, особенно при
отсутствии мелких участков повышенной плотности в ней, напоминает таковую при
кистах, отсутствие эффекта дистального усиления (характерного для кистозного
новообразования) позволяет исключить жидкостный характер новообразования.
Расширение
внепеченочных желчных путей было выявлено при ТАУЗИ у 470 пациентов с
новообразованиями ПЖ проксимальной локализации (диагностическая точность 98%).
Наличие и выраженность механической или смешанной желтухи у данной категории
больных были тактическими критериями при определении показаний к декомпрессии
желчевыводящих путей.
У
520 пациентов с чувствительностью и специфичностью метода – 96% были выявлены
УЗ-признаки панкреатической гипертензии, что является одним из признаков
неопластического поражения. Так, Кубышкин В.А. и соавт., считают, что
расширение ГПП при нормальных размерах и гипоэхогенной структуре головки ПЖ с
большей долей вероятности свидетельствует о наличии опухоли (Кубышкин В.А. и
соавт., 2000).
По
мнению Банифатова П.В. в большинстве случаев опухолей в головке ПЖ
визуализируется расширенный ГПП, причем в отличие от ХП стенки его ровные и
неуплотненные. Визуализация ГПП в пределах гипоэхогенной зоны свидетельствует в
пользу локального отека и против опухоли (Банифатов П.В., 2002).
Инвазия
органов, смежных с ПЖ, выявлена на ТАУЗИ с диагностической точностью 96%.
В
обязательном порядке всем пациентам с новообразованиями ПЖ различной
локализации проводилось исследование взаимоотношения опухоли и магистральных
сосудов панкреатодуоденальной области. Наличие поражения артериальных или
венозных сосудов, его локализация и протяженность являются ключевыми моментами
при выборе метода лечения пациента с раком ПЖ вообще и хирургической тактики в
частности.
По
полученным нами данным диагностическая точность ТАУЗИ (в режиме серой шкалы, в
режиме ЦДК и энергетического допплера) составила 90% в исследовании поражения
венозных магистралей и 93% - артериальных. Столь высокие показатели обусловлены
возможностью эхолокации стенок сосуда, в особенности их наружной поверхности,
задействованной в инвазию в первую очередь.
По
данным Брежневой Л.Э. и соавт. ТАУЗИ позволяет достаточно точно (87-98%)
определить вид и уровень поражения магистральных сосудов по раке ПЖ, а
применение триплексного режима сканирования дает максимально подробную
информацию о проходимости сосудистого русла и виде окклюзии. Применение УЗИ для
определения опухолевой инвазии магистральных сосудов является, по мнению
авторов, предпочтительной вследствие своей неинвазивности, доступности и
высокой информативности (Брежнева Л.Э., Фокин Ал. Ан., Важенин А.В., 2002).
Менее
оптимистичные показатели чувствительности ТАУЗИ в диагностике ангиоинвазии
приводят Кубышкин В.А. и соавт. - 43%. (Кубышкин В.А. и соавт., 2000). В диагностике вовлечения магистральных
сосудов в опухолевый процесс при комплексном УЗИ прорастание достоверно
диагностировано Кармазановским
Г.Г. и соавт. (2001) в 43%
случаев, еще в 32,5% наблюдений отмечено сдавление сосудов опухолью.
Исследование
метастатического поражения лимфатических узлов при раке ПЖ по нашим данным
показало следующие результаты диагностических возможностей ТАУЗИ в сравнении с
морфологической оценкой: чувствительность – 63%, специфичность – 56%, точность
– 60%. Отрицательные результаты при ТАУЗИ лимфоузлов были обусловлены:
размерами лимфатических узлов менее 5 мм; наличием микрометастазов рака;
избыточным весом больных.
Полученные
данные согласуются с мнением Трофимовой Е.Ю., Рубцовой Н.А., Кушнир В.В. о том,
что не всякое увеличение лимфоузлов свидетельствует об их метастатическом
поражении, так как при опухолях возможна лимфоидно-фолликулярная гиперплазия
(Трофимова Е.Ю., Рубцова Н.А., Кушнир В.В., 1999). По данным этих авторов
чувствительность ТАУЗИ в выявлении поражения забрюшинных лимфатических узлов высока
и составляет 78,9%.
Приведенная
в исследованиях Кубышкина В.А. и соавт. чувствительность ТАУЗИ в диагностике
метастатического поражении лимфоузлов составляет
43,6%, специфичность – 95,2% ( Кубышкин В.А. и соавт., 2000) .
ТАУЗИ
остается первым методом лучевой диагностики для скринингового обследования на
предмет выявления очаговых образований печени (Schima W., Strasser G., 2001).
В
настоящем исследовании на ТАУЗИ при раке ПЖ метастатическое поражение одной
доли печени выявлено у 60 пациентов, обеих долей – у 185 больных, из них
множественные метастазы диагностированы в 59,3% случаев. Диагностические
характеристики метода коррелировали с размерами очаговых образований печени:
точность метода по нашим данным при диаметре очагов до 0,5 см составила 94%, более
1,0 см – 99%.
По
данным Кубышкина В.А. и соавт. чувствительность ТАУЗИ в диагностике метастазов
печени размером более 10 мм – 74% при практически абсолютной специфичности
(Кубышкин В.А. и соавт., 2000).
Обобщенные
данные Харнас С.С. и соавт. свидетельствуют о чувствительности ТАУЗИ при раке
ПЖ - 73,8%, специфичности - 75%, общей точности метода – 74,3% (Харнас С.С.,
Кулезнева Ю.В., Лачман Д. (2003).
По мнению Патютко Ю.И. ТАУЗИ позволяет
выявить в ПЖ опухоль размером не менее 1,5 см, определить пораженный отдел ПЖ,
визуализировать ГПП, ВВЖП, установить степень их расширения и уровень стеноза.
В печени – обнаружить метастазы размером не менее 1,0см. Обнаружить увеличенные
лимфоузлы, определить даже небольшое количество свободной жидкости в брюшной
полости. Но в большинстве случаев не позволяет судить о непосредственной
инвазии опухоли в прилежащие к ПЖ ткани и оценить природу и морфологическую
структуру опухоли (Патютко Ю.И., Котельников А.Г., 1997).
Харченко
и соавт. считают, что ТАУЗИ – высокоинформативный метод дифференциальной
диагностики желтух, определения уровня и характера обструкции желчных протоков,
выявления опухолей головки ПЖ, обнаружения метастатического поражения печени и
регионарных лимфатических узлов (Харченко и соавт., 1999).
Причины ошибок ТАУЗИ (Постолов П.М. и соавт., 1991):
1. Субьективные – недостаточная квалификация и небольшой опыт специалиста; перегруженность специалиста.
2. Объективные – значительный метеоризм, наличие пневмоперитонеума или жидкости в брюшной полости, невозможность придать пациенту необходимое положение.
О
том, что трудности получения качественного изображения у полных больных и в
случае метеоризма кишечника способны ограничивать оценку состояния ПЖ
свидетельствуют и данные Зубарева А.В. и Китаева В.В. (1995).
Котляров
П.М. считает ограничением УЗИ невозможность исследовать ПЖ при гепатомегалии и
асците (Котляров П.М., 1999).
Преимущества
трансабдоминальной эхографии по мнению Зубарева А.В. и Китаева В.В.:
неинвазивность, отсутствие биологического воздействия, широкая доступность,
невысокая стоимость исследования (Зубарев А.В., Китаев В.В., 1995).
Кунцевич
Г.И. и соавт. считают, что ТАУЗИ является высоко информативным методом
диагностики рака ПЖ, позволяющим определить наличие опухоли, её структуру,
локализацию и ангиоархитектонику, а также распространённость опухолевого
процесса (Кунцевич Г.И., Журенкова Т.В., Степанова Ю.А., 2004).
Таким
образом, учитывая полученные в исследовании результаты диагностических
возможностей ТАУЗИ, считаем его основным инструментальным методом
дооперационной диагностики рака ПЖ.
Выявление
желчной гипертензии по результатам ТАУЗИ в сочетании с клиническими и
биохимическими признаками желтухи позволяет определить количество этапов
радикального лечения рака ПЖ или необходимость и возможность паллиативных
мероприятий.
Основные критерии неопластического процесса при поражениях ПЖ, оцениваемые при ТАУЗИ, следующие:
1. Локализация и размеры очагового образования.
2. Признаки местного распространения опухоли: прорастание капсулы ПЖ; инвазия сосудистых магистралей панкреатодуоденальной области; прорастание смежных с железой органов.
3. Признаки отдаленного распространения опухоли: лимфогенное метастазирование, метастатическое поражение печени и др. органов.
Применение
ТАУЗИ в комплексе с пункционной биопсией позволяет получать достоверную
информацию о распространенности опухолевого процесса, что на клиническом этапе
способствует правильному выбору тактики лечения. По результатам первичного
ТАУЗИ выставлялись показания к проведению последующих инвазивных и неинвазивных
инструментальных диагностических мероприятий.
Кроме
того, УЗИ имеет несомненные преимущества перед другими методами диагностики,
так как необходимая для его проведения аппаратура имеется практически во всех
лечебных заведениях, и этот метод лишен лучевой нагрузки на пациента.
Ограниченные
возможности ТАУЗИ в диагностике образований печени и ПЖ малого диаметра
(особенно у больных с выраженным метеоризмом) послужили толчком к созданию
метода эндоскопической эхографии, первая попытка которого была предпринята в
1967г. американскими врачами Wild иReid (Бурков С.Г.,
1997).
ЭУЗИ
применяется нами в качестве метода инструментальной инвазивной диагностики с
2004 г.
Показания
к выполнению ЭУЗИ выставлялись на основании результатов первичного ТАУЗИ. Такой
подход согласуется с мнением Панцырева Ю.М. и соавт. (1999) о том, что
выполнение ЭУЗИ рекомендуется после ТАУЗИ и КТ для коррекции диагноза
(определения ангиоинвазии, инвазии в стенку желудка и толстой кишки,
лимфорегионарного метастазирования).
Диагностическая
точность ЭУЗИ по нашим данным была не ниже 94%, а при размерах новообразования
ПЖ более 2см составила 98-99% вне зависимости от локализации опухоли.
По
литературным данным точность ЭУЗИ при раке ПЖ – 99%, при размере менее 3 см
– 100% (Панцырев Ю.М. и
соавт., 1999).
ЭУЗИ
является наиболее точным методом диагностики опухолей ПЖ менее 3 см,
позволяющим установить диагноз у 93% больных (Howard T.J., 1996; Muller et ol., 1994). Информативность определения
новообразований ПЖ размером до 1 см составляет 90-94%. (Харнас С.С., Кулезнева
Ю.В., Лачман Д., 2003).
Преимуществом
ЭУЗИ является возможность осмотра всех анатомических частей ПЖ и близлежащих
структур через стенку желудка и ДПК. (Харнас С.С., Кулезнева Ю.В., Лачман Д.,
2003; Панцырев Ю.М. и соавт., 1999). Однако, в связи с небольшой глубиной
проникновения УЗ-волн при ЭУЗИ в ткани, программа обследования пациентов с
новообразованиями ПЖ должна обязательно включать ТАУЗИ и КТ для точного
определения М-стадии опухоли (Панцырев Ю.М. и соавт., 1999).
Оценка
ЭУЗИ местного распространения опухоли позволила с точностью 96% оценить наличие
или отсутствие ангиоинвазии, что свидетельствует о диагностической
эффективности метода.
Ценность ЭУЗИ в оценке местной
распространенности опухоли ПЖ выше, чем при КТ или лапароскопии (Патютко Ю.И.,
Котельников А.Г., 1997) .
Точность ЭУЗИ в выявлении
метастатического поражения парапанкреатических лимфатических узлов составила
63%, что сравнительно больше иных методов дооперационной диагностики при раке
ПЖ.
Осмотр левой доли печени при ЭУЗИ
позволил по результатам настоящего исследования выявить метастазы диаметром
менее 0,5 см с точностью 96%, а при размерах более 1,0 см диагностическая
точность метода достигла 99%.
Таким
образом, высокая специфичность ЭУЗИ в отношении новообразований ПЖ
свидетельствует об оптимальности его применения для подтверждения диагноза,
предложенного на основании других данных. Столь высокоспецифичный тест крайне
редко дает положительный результат в отсутствие заболевания.
Показаниями к применению ЭУЗИ при новообразованиях ПЖ считаем:
1. Выявленное по результатам ТАУЗИ метастатическое поражение правой доли печени (для достоверного исключения метастазов левой доли);
2. Выявленное по результатам ТАУЗИ прорастание опухолью ПЖ смежных органов;
3. Выявленная по результатам ТАУЗИ инвазия артериальных и венозных магистралей панкреатодуоденальной области;
4. Сочетание вышеперечисленных показаний.
Постановка
диагноза заболевания ПЖ в сложных дифференциально-диагностических случаях, так
же, как и определение стадии неопластического процесса имеет стратегическое
значение при раке ПЖ. Высокая частота эксплоративных лапаротомий, приводимая в
отечественной литературе, свидетельствует об определенных трудностях
дооперационного диагноза опухоли ПЖ, наличия местного распространения и
отдаленного метастазирования.
Лапароскопия позволяет обнаружить
опухоль ПЖ лишь в 40% наблюдений, но дает возможность выявить метастатическое
поражение у 55% больных и воздержаться от бесполезных и опасных хирургических
вмешательств по мнению Caldironi M.W. et ol., 1996.
Лапароскопия, дополненная ЛУЗИ,
позволяет с высокой диагностической точностью определить индивидуальную тактику
лечения до нанесения хирургической лапаротомной раны. Диагностическая ценность лапароскопии
возрастает при использовании её в комбинации с ЛУЗИ и по мнению Патютко Ю.И. и
Котельникова А.Г., 1997.
Кроме того, по данным Старкова Ю.Г.,
2000, у ЛУЗИ имеются преимущества в виде видеосистем высокого разрешения,
дающих возможность ассистирования и принятия коллегиального решения.
Полученная в наших исследованиях
диагностическая точность ЛУЗИ в выявлении опухолевых поражений ПЖ различной
локализации составила 76-99% в зависимости от размеров опухолевого очага. При
этом образования диаметром более 0,5 см были диагностированы с точностью не
менее 91%, что согласуется с литературными данными. Чувствительность и
специфичность ЛУЗИ в диагностике опухолей ПЖ – 99% и 92% соответственно
составила по результатам исследования Харнас С.С., Кулезнева Ю.В., Лачман Д.,
2003.
Оценка распространенности опухолевого
процесса ПЖ при диагностической лапароскопии с ЛУЗИ показывает полное
совпадение с интраоперационными критериями резектабельности опухоли (Кубышкин
В.А. и соавт., 2000). По результатам настоящего исследования, чувствительность
ЛУЗИ в диагностике опухолевой инвазии венозных магистралей
панкреатодуоденальной области составила 92%, артериальных – 89%. Подтверждение
при ЛУЗИ результатов диагностики ангиоинвазии неинвазивными методами
исследований в 21 случае послужило отказом от выполнения
радикального оперативного вмешательства, в
4 случаях – позволило выбрать
расширенную ПДР как вариант хирургической тактики. Местное распространение
опухоли ПЖ с вовлечением смежных органов лишь уточнялось при ЛУЗИ (границы и
глубина инвазии).
Особое
значение имеет метод ЛУЗИ для обнаружения интрапаренхиматозных метастазов
печени при раке ПЖ. Выявленные с диагностической точностью 91-99% отдаленные
метастазы, детерминировали отказ от радикального оперативного лечения у 42
пациентов. При этом диагностические возможности ЛУЗИ в выявлении очаговых
образований печени диаметром менее 0,5 см позволили диагностировать отдаленное
метастазирование у 6 пациентов. Возможность осмотра при ЛУЗИ обеих долей печени
давало ему вполне определенные преимущества перед ЭУЗИ в диагностике
метастатических очагов.
По
мнению Кубышкина В.А. и соавт., 2000, лапароскопия с ЛУЗИ позволяет
диагностировать интрапаренхиматозные печеночные метастазы малых размеров
(которые не были обнаружены при ТАУЗИ, КТ и лапароскопии), оценить
парапанкреатические клетчаточные пространства и состояние лимфатических
коллекторов в объеме R3, изучение эхоструктуры всех отделов ПЖ.
Метастазы
рака ПЖ в лимфатические узлы были достоверно выявлены при ЛУЗИ у 15 пациентов.
Диагностированный положительный результат в 4 случаях оказался ложным; по
данным патогистологического исследования визуализированные изменения
лимфатических узлов были обусловлены реактивной гиперплазией.
Таким
образом, ЛУЗИ по результатам нашего исследования, придается особое значение в
диагностике злокачественных новообразований ПЖ.
Показанием к выполнению ЛУЗИ считаем:
· эхолокацию метастазов только левой доли печени при ТАУЗИ и/или ЭУЗИ.
Диагностика
отдаленного метастазирования при раке ПЖ, особенности локализации и размеры
очагов печени, имеют стратегическое значение при выборе индивидуальной лечебной
тактики таких пациентов.
КТ
как метод неинвазивной инструментальной диагностики применяется нами с 1992
года. Во всех случаях КТ не была первичным методом исследования – трактовка
полученных результатов производилась с учетом данных предыдущего ТАУЗИ.
Полученные
в настоящем исследовании результаты диагностических возможностей КТ при
опухолях ПЖ свидетельствуют
о наличии определенных трудностей в диагностике этой патологии данным методом.
Диагностическая точность метода в локации новообразования была от 9% до
87% в
зависимости от размеров и локализации.
В исследованиях Патютко Ю.И. и соавт.
показана информативность КТ при опухолях ПЖ от 35 до 88% (Патютко Ю.И.,
Котельников А.Г., 1997).
Чувствительность
КТ при раке ПЖ по данным Котлярова П.М. составляет 88%, специфичность – 60%
(Котляров П.М., 1999).
Панцырев
Ю.М. и соавт. в своих исследованиях приводят точность КТ при раке ПЖ – 77-86%,
при размере менее 3 см – 62-64 (Панцырев Ю.М. и соавт., 1999).
Об
информативности КТ близкой к таковой при ТАУЗИ свидетельствуют результаты
исследования Харнас С.С., Кулезневой Ю.В., Лачмана Д. (2003).
Изучение
диагностических возможностей КТ в выявлении ангиоинвазии по нашим данным
показало пределы точности метода 55%. Полученные данные не позволяют относить
КТ к основным методам диагностики этого тактически важного инструментального
критерия.
Диагностическая
точность 35% получена при исследовании метастатического поражения лимфатических
узлов в сравнении с морфологическими данными.
В
исследовании других авторов чувствительность спиральной КТ в определении
ангиоинвазии составила 71%, метастатической лимфоаденопатии – 75%. (Кубышкин
В.А. и соавт., 2000) .
Диагностическая
точность КТ в выявлении метастатического поражения печени по нашим данным
составила 95-94%. Необходимо, однако, отметить, что такие показатели
обусловлены в большей степени низкой частотой ложноположительных результатов, в
то время как значительная частота ложноотрицательных результатов отразилась в
показателях чувствительности метода (20-59%).
Чувствительность
спиральной КТ в определении метастазов печени составила 61,5% (при размере
более 10мм – 100%). (Кубышкин В.А. и соавт., 2000).
Из недостатков КТ по литературным данным отмечено следующее (Зубарев А.В., Китаев В.В., 1995; Pettersson H., 1995; Кубышкин В.А. и соавт., 2000; Харнас С.С., Кулезнева Ю.В., Лачман Д., 2003):
1. Жесткая привязка получаемых изображений к поперечной плоскости;
2. Возможные пропуски срезов во время дыхания;
3. Артефакты движения;
4. Неадекватное контрастирование прилегающих к ПЖ отделов ДПК;
5. Недостаточное анатомическое дифференцирование от окружающих тканей;
6. Высокая стоимость метода;
7. Значительная лучевая нагрузка.
Основным
преимуществом метода КТ по мнению Кубышкина В.А. и соавт. (2000) является
возможность оценки результатов исследования по жестким копиям и меньшая
зависимость от оператора.
Зубарев
А.В и Китаев В.В., (1995) считают, что КТ нужно применять обязательно в комплексе с другими инструментальными
и лабораторными методами диагностики, предусматривая в необходимых ситуациях и
инвазивные диагностические процедуры (Зубарев А.В.,).
Попытки
прогресса в лечении злокачественных новообразований ПЖ предпринимаются в двух
тактических направлениях: увеличение объема операции и применение
комбинированного лечения (Патютко Ю.И., Котельников А.Г., 1997). Расширение
объема операции происходит за счет лимфодиссекции R3-R4 и резецирования магистральных сосудистых структур
панкреатодуоденальной области. Частота местнораспространенного периампулярного
рака достигает 55% (Патютко Ю.И., Котельников А.Г., 1998). При этом поражение
опухолью магистральных сосудов периампулярной области сопровождает порядка 30%
случаев местного распространения.
Очевидно,
что тактика лечения рака ПЖ в значительной степени зависит от дооперационной
диагностики вовлечения в неопластический процесс жизненно важных артериальных и
венозных структур данной локализации. Высокая точность диагностирования
ангиоинвазии именно на дооперационном этапе позволяет исключить эксплоративную
лапаротомию либо провести адекватную подготовку к оперативному вмешательству
расширенного объёма.
С
1953 г. ангиография была наиболее точным окончательным методом в диагностике
опухолей ПЖ (Pettersson H., 1995; Харнас
С.С., Кулезнева Ю.В., Лачман Д., 2003). В настоящее время в связи с
инвазивностью метода и наличием альтернативных безопасных диагностических
процедур (ТАУЗИ), применение рентгенангиографических методик ограничено
потребностью выявления ангиоинвазии, но не размеров и локализации
новообразований ПЖ (Pettersson H., 1995; Богданенко С.Ф. и соавт.,
2000).
Полученные
в настоящем исследовании результаты диагностической точности мезентерико- и целиакографии
свидетельствуют о возможности выявления вовлечения артериальных магистралей в
неопластический процесс при инвазии опухолью всех слоев сосудистой стенки либо
выраженной компрессии сосуда. Гистологические особенности строения медии
артериальных сосудов позволяют даже при прорастании адвентициального слоя
сохранять диаметр и внутренний контур сосуда (визуализируемый при
рентгенэндоваскулярных методах) неизмененным. Исходя из полученных
ангиографических и интраоперационных данных, видится необходимым применение
диагностических методов инвазии артерий, позволяющих оценить слои сосудистой
стенки, прилегающие к опухолевому очагу.
В
диагностике инвазии венозных магистралей панкреатодуоденальной области
результаты диагностической точности АГ несколько выше. Даже начальное
вовлечение в опухолевой процесс брыжеечной, селезеночной или воротной вены
проявляется изменением рельефа контуров или диаметра сосуда. Более инвазивный
процесс приводит к тромбообразованию в просвете вены и развитию коллатерального
кровообращения.
Полученные
результаты диагностической точности АГ согласуются с данными Патютко Ю.И. и
Котельникова А.Г., 1997, отмечающих в своих публикациях, что в 15% случаев
результаты АГ ложноположительны, а у 30% - ложноотрицательны. Богданенко С.Ф. и
соавт. (2000), приводят в своих исследованиях равновероятную частоту
ложноположительных и ложноотрицательных результатов АГ в 20,7% случаев.
При
выполнении рентгенконтрастного исследования портальной системы нами отдается
предпочтение возвратной спленопортографии, как методу, позволяющему
визуализировать воротную вену и её притоки сравнительно адекватнее и
безопаснее, чем при спленопортографии и чреспеченочной портографии. В случаях
полного опухолевого тромбоза воротной или селезеночной вен, гипертензия в
паренхиме селезенки может послужить причиной серьезного осложнения при
спленопортографии, что является одной из причин ограничения применения данного
метода АГ при раке ПЖ.
Все
возможные осложнения при проведении АГ можно разделить на технические и
токсические (Рабкин И.Х., 1977). Технические осложнения связаны с
непосредственным повреждением сосудов, повреждением внутренних органов,
расположенных поблизости к сосуду и эмболией. К токсическим осложнениям
относится токсическое воздействие контрастного вещества.
По
мнению ряда авторов (Харнас С.С., Кулезнева Ю.В., Лачман Д., 2003) АГ является
инвазивным методом, связанным с высоким риском развития различных осложнений:
гематомы (19,6%), кровотечения из места пункции, реакции на контрастные
вещества и абсцессы на месте пункций.
В
нашем исследовании частота осложнений АГ составила 5,7%.
Сравнить
диагностические возможности интраскопических методов в выявлении опухолевой
инвазии наглядно на рис. 4.10.1., где преимущества ультразвуковых методов
отражено наглядно.
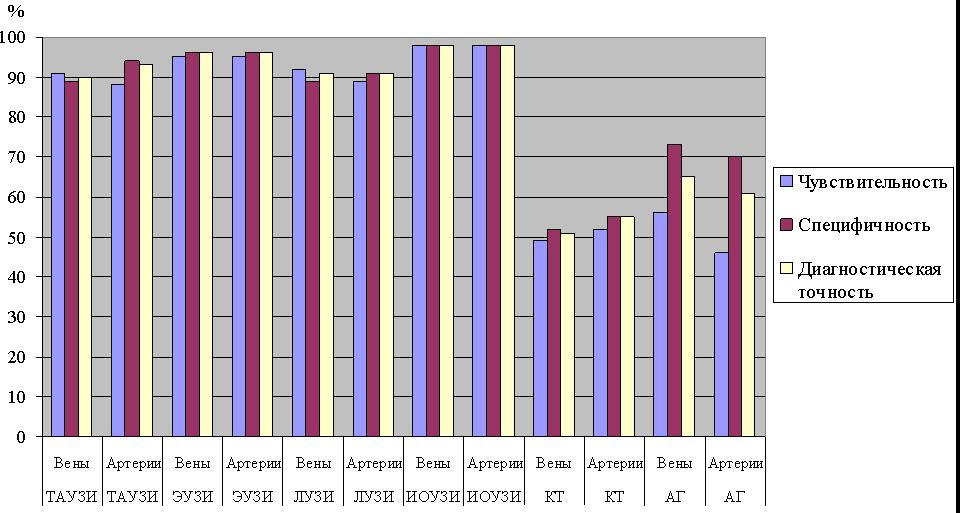
Рисунок
4.10.1. Диагностические возможности ТАУЗИ. ЭУЗИ. ЛУЗИ., ИОУЗИ, КТ, АГ при
выявлении инвазии опухоли в магистральные сосуды при раке ПЖ.
По
мнению Богданенко С.Ф. и соавт. (2000) с течением времени наблюдается резкое
сокращение числа ангиографических исследований при заболеваниях ПЖ. АГ
позволяет выявить очаговые поражения ПЖ с вероятностью 23,4%, значительно
уступая в достоверности ТАУЗИ и КТ.
Рентгенконтрастирование
применялось и при исследовании протоковых структур. Постоянное совершенство
техники неинвазивных методов визуализации постепенно снижает необходимость в
проведении диагностической РПХГ при подозрении на наличие у пациентов
доброкачественных или злокачественных опухолей ПЖ. Показания к лечебной ретроградной
холангиографии, напротив, постоянно расширяются - она применяется в качестве
дополнения при выполнении декомпрессионных мероприятий у больных с синдромом
портальной гипертензии при проксимальном расположении опухоли ПЖ
(установка пластикового или металлического стента).
Pettersson H. (1995) указывает, что
рентгенконтрастное исследование дает информацию о системе протоков ПЖ, но не об
её паренхиме.
По
мнению Зубарева А.В.и Китаева В.В. (1995) точность распознавания рака ПЖ при
РПХГ – 90%. Основной симптом – это частичная или полная обтурация
панкреатического протока. Однако, имеются затруднения в дифференциальной
диагностике доброкачественного и злокачественного процесса. Кроме того, метод
не эффективен в установлении стадии рака ПЖ (нет информации о распространенности
процесса за пределы протоков и, тем более, метастазах в органы и лимфатические
узлы). РПХГ используется в качестве контроля при установке стентов или
баллонной дилатации протоков (Зубарев А.В., Китаев В.В., 1995).
Точность
РПХГ при раке ПЖ – 90-94%, при размере менее 3 см – 85-86% (Панцырев Ю.М. и
соавт., 1999). Kakaria et ol. (1989) считают, что точность РПХГ при
очаговых поражениях ПЖ достигает 96,7%, однако УЗИ неинвазивный, более простой
и доступный метод.
По
результатам данного исследования чувствительность РПХГ в диагностике
новообразований ПЖ составила 94%, специфичность – 92%.
По
нашему мнению, РПХГ позволяет произвести забор материала на цитологическое
исследование и производить паллиативные вмешательства для восстановления проходимости
желчных протоков. Однако, по мере совершенствования визуализирующих методик
стало возможным произведение аспирации и биопсии тканей под контролем
сонографии, вследствие чего необходимость в выполнении ретроградной
панкреатографии исключительно с целью забора образца ткани опухоли,
локализующейся в теле или хвосте ПЖ, возникает все реже.
По принятой нами методике хирургического
лечения всех неоплазм вообще и новообразований ПЖ в частности, всем пациентам в
обязательном порядке следующим этапом после выполнения операционного доступа
проводилось ИОУЗИ и только после получения результатов этого исследования
формулировалась окончательная индивидуальная хирургическая тактика.
Кроме того, на настоящий момент ИОУЗИ является единственным
визуализационным методом, с помощью которого можно оценить состояниеглубокорасположенных структур печени и получить
информацию,позволяющую избежать
интраоперационных осложнений и адекватно произвести оперативное вмешательство при её метастатическом поражении.
На основании имеющегося у нас опыта интраоперационных сонографических осмотров, мы сформулировали особенности ИОУЗИ, выполнение которых необходимо для получения исчерпывающей и достоверной диагностической информации:
1. четкая формулировка цели исследования;
2. правильный выбор сонологического инструмента;
3. выполнение первичного интраоперационного УЗ-осмотра до этапа мобилизации органов и вмешательств на протоковых структурах.
Перечисленные
обязательные условия являются залогом точности интраоперационной ультразвуковой
диагностики.
Необходимо отметить, что в последние годы расхождение в
до- и интраоперационном диагнозе в нашей клинике при раке ПЖ сведено к
минимуму, что свидетельствует о несомненном прогрессе диагностических
технологий.
ИОУЗИ
- безопасная для пациента и, что не маловажно, медицинского персонала
диагностическая процедура. Возможность контролировать границы злокачественного
процесса на некотором расстоянии, не контактируя с ним инструментом или руками
при отсутствии непосредственной визуализации, позволяет хирургу сохранить
абластичность оперативного вмешательства, улучшая тем самым отдаленные
результаты лечения неоплазм различного генеза.
Исходя
из опыта выполнения ИОУЗИ, считаем оптимальным освоение методики выполнения и
трактовки визуализированных результатов ИОУЗИ всеми оперирующими хирургами. В
этом случае, применение данного вида диагностики в любой момент востребования
по ходу оперативного вмешательства не требует участия дополнительных
специалистов и позволяет хирургу уверенно ориентироваться в патологически
измененных тканях, экономя время и снижая количество осложнений.
Микроконвексные УЗ-датчики становятся одним из постоянных инструментов на
хирургическом столике, являясь как бы «третьим глазом» оперирующего хирурга,
преимуществами которого перед врачом-сонологом является лучшая ориентировка в
постоянно изменяемой им по ходу вмешательства топографической ситуации.
Можно выделить основные правила выполнения ИОУЗИ:
· выполнение ИОУЗИ показано всем пациентам, подвергающимся открытому оперативному лечению по поводу новообразований ПЖ;
· до выполнения сонографического осмотра должны быть поставлены четкие диагностические цели, так как исследование поставлено в жесткие временные рамки; можно сказать, что в данной ситуации длительность диагностики не должна превышать её клинической значимости;
· выполнение первичного ИОУЗИ производится сразу после осуществления операционного доступа до смещения органов брюшной полости;
· при результатах дооперационных исследований, свидетельствующих о возможной нерезектабельности опухоли, операционный доступ делается минимально необходимым для выполнения ИОУЗИ и лишь после интраоперационного исследования принимается решение о расширении доступа, что позволяет уменьшить операционную травму у инкурабельных пациентов;
· количество интраоперационных сонографических осмотров не ограничено; мобилизация органов под перманентным сонографическим контролем позволяет избежать ятрогенных повреждений жизненно важных структур, тем самым сокращая количество осложнений и длительность операции;
· оптимально выполнение ИОУЗИ оперирующим хирургом, что позволяет ему уверенно ориентироваться в патологически измененных тканях, не применяя пальпацию, и повышает комплаэнтность врача к диагностической методике;
· выполнение ИОУЗИ осуществляется набором датчиков, разнообразных по форме, радиусу и длине рабочей поверхности, позволяющих получить максимум информации при визуализации органов различной формы на различной глубине;
· ИОУЗИ производится полипроекционно; акустическое окно при необходимости создается за счет интерпозиции другого органа (печень, сальник, кишка, желудок или заполнения брюшной полости жидкостью);
· интраоперационному УЗ-осмотру в обязательном порядке подвергается области первичного очага, регионарного и юкстарегионарного лимфооттока, магистральные сосуды и печень;
· врач-сонолог при проведении ИОУЗИ является консультантом; при необходимости заключение дается коллегиально.
При
осуществлении интраоперационного УЗ-осмотра оперирующим хирургом,
врачу-сонологу отводится роль консультанта в сложных диагностических случаях.
Несомненно, что интраоперационное использование сонографических возможностей
открывает определенные перспективы при хирургическом лечении опухолей вообще и
новообразований ПЖ в частности.
Морфологическая
оценка новообразования ПЖ или метастатического поражения лимфатических узлов и
печени произведена у 543 пациентов.
При
этом на дооперационном этапе выполнялась пункция патологического очага под
сонографическим контролем (340 манипуляций).
Морфологическое
исследование операционного материала выполнено 203 пациентам, подвергшимся
радикальным резекциям опухоли ПЖ или взятого из патологических очагов при
лапаротомии.
В
данной работе диагностическая информация инструментальных методов исследования
была сопоставлена с результатами гистологического исследования у каждого
пациента.
Рисунок 4.10.1
Количество
и качество оперативных вмешательств при новообразованиях ПЖ в различные
периоды с 1992 по 2005 г.г.
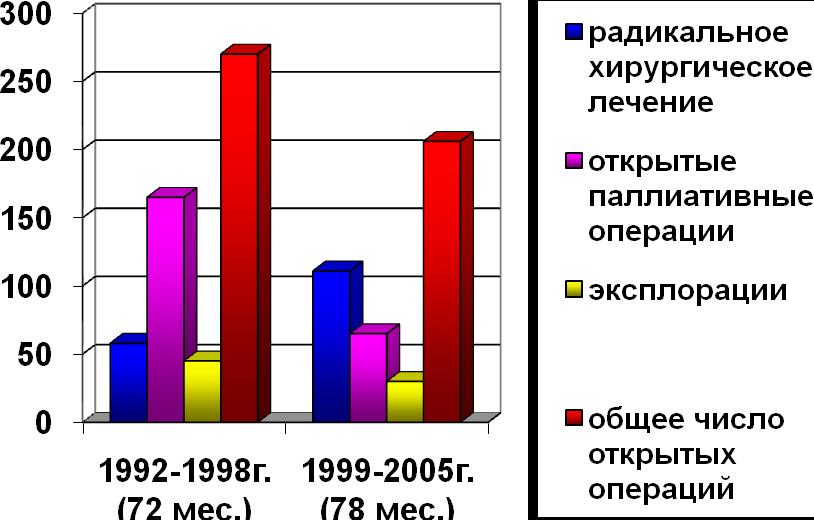
514 пациентов 709
пациентов
Проведен
анализ временной зависимости частоты и мозаики оперативных вмешательств при
новообразованиях ПЖ (рис. 4.10.1).
Количество
пациентов с данной патологией, находившихся на обследовании и лечении с 1999 г.
по 2005 г. увеличилось на 27,5% в сравнении с начальным периодом. Однако
определенный интерес вызывает исследование оперативной деятельности по поводу
новообразований ПЖ за эти периоды.
На
рис. 4.10.1 видно, что количество пациентов, подвергшихся радикальному
оперативному лечению, увеличилось на 47,7%, что свидетельствует о несомненном
расширении и совершенствовании хирургических технологий. В то же время,
количество эксплоративных вмешательств уменьшилось на 33,3%. Очевидно, что
такой сдвиг обусловлен повышением клинической эффективности дооперационных
методов диагностики. Снижение числа открытых паллиативных операций при
новообразованиях ПЖ на 60,6% связано с развитием малоинвазивных хирургических
технологий, позволяющих достигать декомпрессионного эффекта у неоперабельных
пациентов без выполнения лапаротомии.
Резюме.
В данной главе проведен анализ диагностической эффективности всех используемых в клинике инструментальных методов, при раке ПЖ и их влияния на формирование лечебной тактики.
Краснодар - Москва - 2008 г.
· Новиков С.В.
· кмн, врач-хирург высшей категории, врач УЗД,
· специалист по минимально инвазивным хирургическим вмешательствам под контролем ультразвука
· НИИ СП им.Н.В.Склифосовского, г.Москва